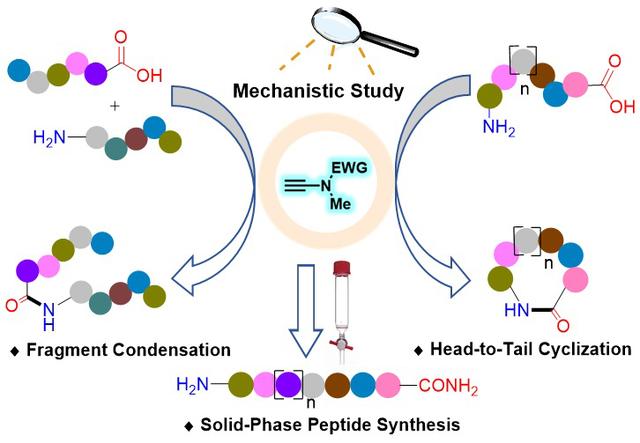
各功能蛋白质组学的研究方法(炔酰胺介导的肽键形成)
多肽由于具有高生物活性、低毒性和高特异性等特点,在药物研发、疾病诊断、材料科学和化妆品等领域有着广泛的应用,多肽合成因此成为了一个备受关注的研究领域。肽键(α-氨基酸之间的酰胺键)形成反应是多肽合成的核心,在过去的100多年间,化学家开发了很多种酰胺键形成方法。但是能够用于多肽合成的方法却非常有限,其主要原因是这些方法的手性原料难以获得,不利于用来构建肽键。相反,天然α-手性氨基酸便宜易得,因此目前应用最广泛、最可靠的多肽合成方法仍然是α-氨基酸在缩合剂作用下脱水缩合形成肽键。然而传统缩合剂用于肽键的构建时,由于其对α-手性氨基酸的过度活化而经常诱发α-位手性中心的外消旋化及其它副反应。此外,当前多肽合成所用的试剂和技术主要是上世纪50-80年代开发的,当时绿色化学的概念尚未形成,因此原子经济性很差,产生大量的化学废物,不仅导致多肽的生产成本高昂,而且不利于可持续发展。而这些问题仅仅依靠技术层面上的优化是难以解决的,只能通过肽键形成原理上的创新才有望获得彻底解决。
广州医科大学赵军锋课题组针对上述多肽合成中的难题,发展了原创型的炔酰胺类缩合剂,实现了肽键的高效无外消旋化构建,为解决多肽合成中的外消旋化问题提供了一种强有力的工具 (J. Am. Chem. Soc. 2016, 138, 13135-13138)。近日,他们与南京工业大学赵莉莉课题组合作,在前期报道炔酰胺缩合剂的基础上,通过对炔酰胺介导的肽键构建进行了深入系统的动力学、结构-反应活性关系、密度泛函理论计算等机理研究,阐明了炔酰胺缩合剂的作用机制,成功将炔酰胺介导的无外消旋化的肽键形成从简单的二肽合成延展至多肽片段连接、直链肽首尾环化及固相多肽合成,实现了炔酰胺缩合剂在多肽合成领域应用的全覆盖。
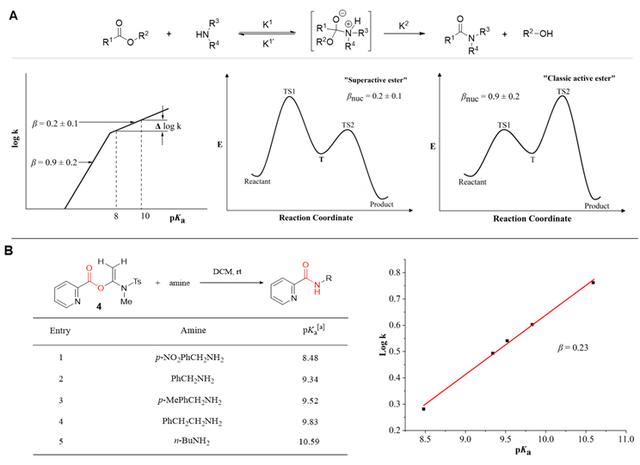
首先,作者对炔酰胺介导的“两步一锅法”肽键形成进行了动力学研究。其结果表明,在羧基活化过程中,α-酰氧基烯酰胺活化酯的生成速率与炔酰胺呈现零级反应关系,而与羧酸呈现一级反应关系;在接下来的活化酯氨解过程中,酰胺键的形成速率与活化酯和胺均呈现一级反应关系,为改善反应速率提供了理论指导。为进一步剖析氨解过程,作者进行了胺的碱性与反应活性关系的研究,来确定氨解反应的决速步。其结果表明,在α-酰氧基烯酰胺活化酯氨解反应过程中,四面体中间体的形成是氨解反应的决速步,这与经典活化酯氨解反应中四面体中间体崩塌的决速步完全不同。
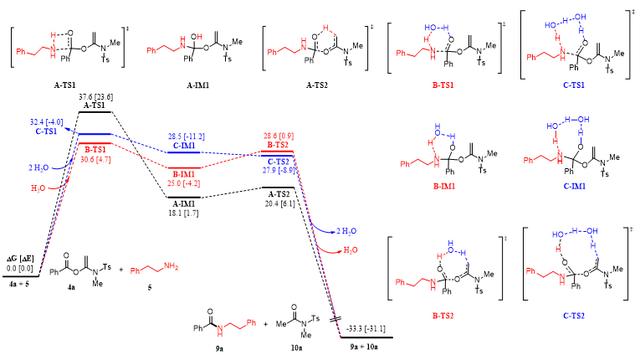
基于动力学和结构-反应活性关系的研究结果,作者对影响α-酰氧基烯酰胺活化酯氨解反应速率的因素进行了系统的分析和验证,发现溶剂化效应对氨解反应速率有显著的影响,尤其是在水或水和DMSO混合物作为溶剂时,肽键形成的反应时间从之前的10-24 h缩短至1-2 h。并且水分子通过氢键网络加速氨反应解速率的现象得到了理论计算的支持。
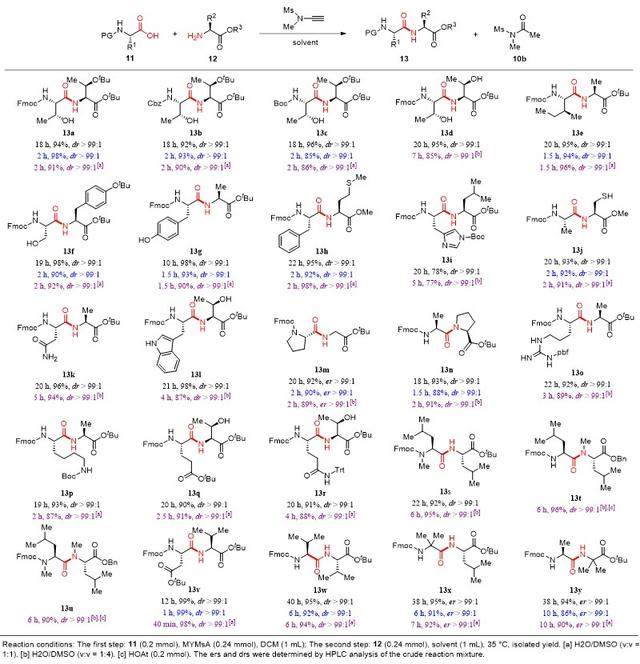
然后,在水相反应条件下,作者对炔酰胺介导的肽键形成策略进行了底物适用性研究。实验结果表明,以水或水和DMSO混合溶液作为溶剂时,20种天然α-氨基酸作为羧酸组分或氨基组分都可以几乎定量的收率得到目标二肽,且与DCM作为溶剂时相比,反应速率得到大幅提高。同时,该反应策略具有极好的酰胺化选择性,使得α-氨基酸含有的羟基、巯基、伯酰胺、吲哚等活泼侧链官能团和Fmoc、Boc、Cbz等氨基保护基具有很好的兼容性。值得说明的是,α-手性氨基酸在该条件下构建肽键的过程中,仍然可以很好的避免α-位手性中心外消旋化副反应的发生。对于一些具有较大位阻的氨基酸,适当延长反应时间同样可以优秀的收率得到目标二肽。除了20种天然α-氨基酸和一些具有较大位阻的非天然氨基酸外,作者还尝试将这种肽键构建策略用于更具挑战性的N-甲基氨基酸。有趣的是无论N-甲基氨基酸作为羧酸组分还是氨基组分,甚至同时作为羧酸和氨基组分,都能以很好的收率得到目标二肽,并且不会发生α-位手性中心外消旋化。最后,作者还成功实现了以组氨酸作为羧酸组分的二肽合成,而这类二肽的合成使用传统缩合剂是比较难实现的。
由于多肽片段连接涉及多肽片段羧酸的活化与氨解,而与脲烷型保护基保护的单个氨基酸相比,多肽片段羧酸的活化与氨解更容易发生α-位手性中心外消旋化,所以缩合剂介导的多肽片段连接比简单二肽合成更具挑战性。为了充分展示炔酰胺缩合剂不诱发外消旋化的优势,作者尝试将炔酰胺缩合剂用于多肽片段连接。采用“两步一锅法”肽键构建策略,作者首先尝试了相对简单的[2 1]和[2 2]多肽片段连接,均以优良的收率得到目标肽链,并且没有α-位手性中心外消旋化,证明炔酰胺缩合剂用于多肽片段连接是可行的。接下来,作者将这一合成策略扩展到[3 1]、[3 2]、[4 2]、[5 3]、[6 2]和[6 3]等长链多肽片段连接,五肽胃泌素、奥曲肽、加压素等多肽药物及其类似物等均可通过该策略以很好的收率获得,连接效率不受氨基酸连接位点的影响。更重要的是,炔酰胺缩合剂介导的多肽片段连接均没有消旋化(差向异构化)副反应发生,这一策略无疑为长链多肽的合成提供了一种极富吸引力的方法。

环肽由于其独特的刚性结构和透膜性在药物研发领域表现出显著的优势,受到科学家的广泛关注,各种环肽合成方法被相继报道,其中缩合试剂介导的直链肽首尾环化是一种最直接有效的环肽合成策略。然而,传统缩合试剂介导的首尾环化往往存在二聚或多聚、关环位点α-位手性中心外消旋化等问题。考虑到炔酰胺缩合剂在肽键形成中不消旋的优势,作者尝试将炔酰胺缩合剂应用于直链肽的首尾环化。通过条件优化,作者成功实现了炔酰胺介导的直链肽首尾环化。以直链五肽为模型,他们比较了炔酰胺缩合剂与传统缩合剂在首尾环化中的效果。当使用DCC、HATU、HBTU、PyBOP等传统缩合剂时,有显著的环二聚、差向异构化等副产物生成。相比之下,炔酰胺缩合剂可以避免差向异构化副产物的生成,并且只观察到微量的环二聚体副产物,当作者进一步降低反应物浓度时,基本可完全避免环二聚副反应的发生。

为了进一步考察炔酰胺缩合剂在首尾环肽合成中的适用性,作者制备出一系列含不同数目(5-12个)氨基酸的直链肽,这些直链肽在炔酰胺缩合剂的作用下均以较好的收率获得目标环肽,其中包括Stylostatin 1、Phakellistatin 13、Mahafacyclin B、Dichotomin G、Phakellistatin 12、Stelladelin D等生物活性环肽。炔酰胺介导的直链肽首尾环化策略展现出了广谱的关环位点范围,并且对羟基、伯酰胺、吲哚等活泼侧链官能团具有很好的兼容性,间接缓解了直链肽环化过程中溶解性差的问题。更重要的是,这些直链肽在首尾环化的过程中连接位点都没有发生α-位手性中心外消旋化,而且还能够用于较大量的环肽合成。这些实验结果充分证明炔酰胺缩合剂可以作为一种操作简单、连接位点广谱且不诱发差向异构化的缩合剂用于多肽首尾环化。

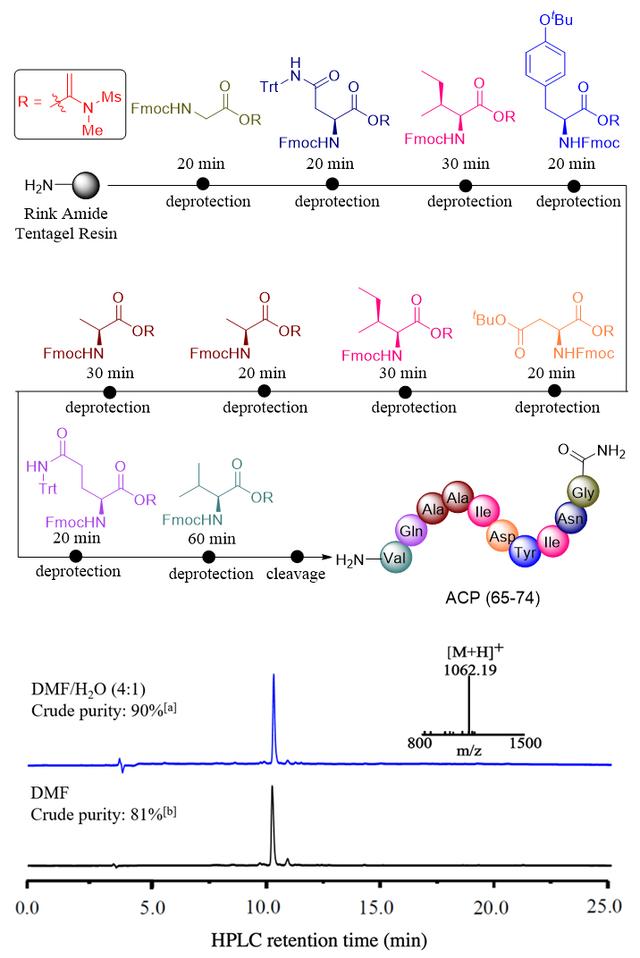
作者在前期的研究中已知,各种天然氨基酸和非天然氨基酸都可以很容易地与炔酰胺反应生成α-酰氧基烯酰胺活化酯,这些α-酰氧基烯酰胺活化酯有较好的稳定性,在冰箱中至少可保存6个月而不发生变质。遗憾的是α-酰氧基烯酰胺活化酯的氨解反应速率低、耗时长,不利于固相多肽合成(SPPS)。在本研究中作者发现水的存在能大幅提高α-酰氧基烯酰胺活化酯的氨解反应速率,因此作者尝试发展以含水溶剂为介质的固相多肽合成,探索α-酰氧基烯酰胺活化酯在固相多肽合成中的应用。以在水中可溶胀的树脂为载体,通过条件优化,当以水和DMF混合物(4:1)为溶剂时,氨基酸α-酰氧基烯酰胺活化酯在固相树脂上的氨解反应时间显著缩短至20-30分钟,这一改进使该方法能够与传统的固相多肽合成相竞争。接下来,作者选取经典的困难十肽ACP(65-74)为模型,探索α-酰氧基烯酰胺活化酯在固相多肽合成中的效率。实验结果显示,在最优反应条件下,固相树脂上的每一步缩合反应都能在30分钟内完成,即便是具有挑战性的最后一个缬氨酸,也可以通过适当延长反应时间成功连接上。使用这种合成策略,作者最终获得纯度为90%的困难十肽ACP(65-74)粗产物。这一研究结果表明α-酰氧基烯酰胺活化酯完全可以作为砌块用于固相多肽合成。
总之,作者通过深入系统的动力学、结构-反应活性关系、密度泛函理论计算等研究,阐明了炔酰胺介导的酰胺键形成反应机制。基于反应机理研究,作者成功将炔酰胺介导的酰胺键形成策略的应用范围从简单的酰胺和二肽合成拓展至多肽片段连接、首尾环化和固相多肽合成,实现了炔酰胺缩合试剂在多肽合成应用领域的全覆盖。炔酰胺缩合试剂汇集了传统活化酯和缩合试剂的优点,同时避免了它们的不足,为多肽化学合成开辟了一条新途径。可以预见,这种高效实用的肽键形成策略将在多肽合成中获得广泛的应用。相关研究成果以研究全文形式发表在Angew. Chem. Int. Ed.上。
Ynamide-Mediated Peptide Bond Formation: Mechanistic Study and Synthetic Applications
Silin Xu, Dandan Jiang, Zejun Peng, Long Hu*, Tao Liu, Lili Zhao*, Junfeng Zhao*
Angew. Chem. Int. Ed., 2022, DOI: 10.1002/anie.202212247
导师介绍
赵莉莉
https://www.x-mol.com/university/faculty/339848
,免责声明:本文仅代表文章作者的个人观点,与本站无关。其原创性、真实性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容文字的真实性、完整性和原创性本站不作任何保证或承诺,请读者仅作参考,并自行核实相关内容。






